Cinética.
El objetivo de la cinética es el estudio de la rapidez de reacción, de
los factores que la afectan y el establecimiento del mecanismo mediante el cual
se efectúa la reacción.
La velocidad.
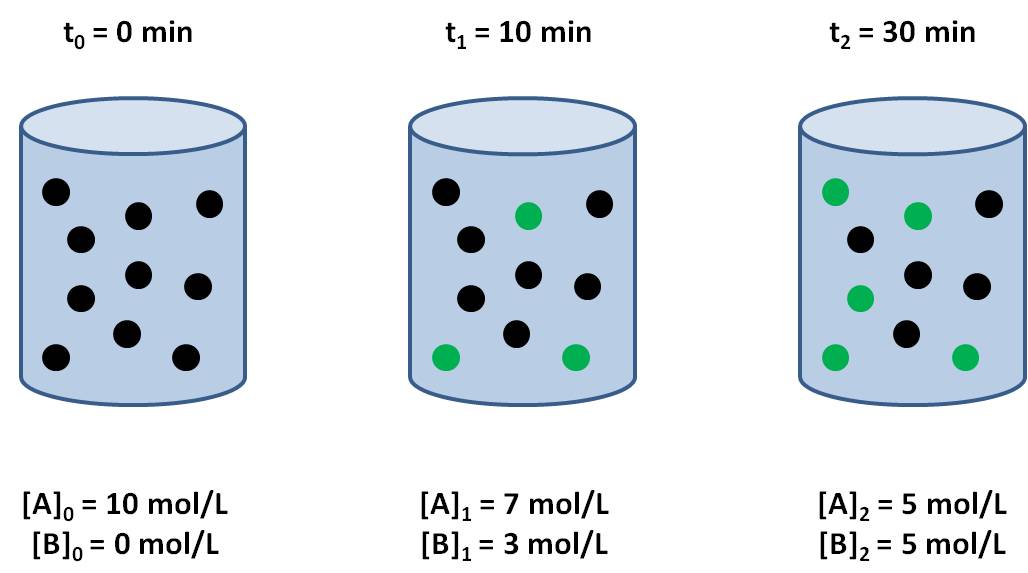
Se produce una reacción química se
puede expresar en términos de la variación de la cantidad de materia de un
reactivo por unidad de tiempo. Varía con las concentraciones de los reactivos.
Cuando se expresa la relación entre velocidad de reacción de los productos y
velocidad de reacción de los reactivos, se obtiene la llamada "constante
de equilibrio" de la reacción. Tantos las velocidades señaladas como la
constante obtenida son en realidad resultantes de un análisis termodinámico de la
reacción.
En general, las reacciones pueden clasificarse en:
- irreversibles
- reversibles endotérmicas
- reversibles exotérmicas
dependiendo si se realizan en sistemas abiertos,
semicerrados o cerrados.
Mecanismos de Reacción.
Un mecanismo de reacción es un conjunto de etapas
(ó reacciones ) elementales mediante las cuales se postula que transcurre una
reacción química. La descripción de un mecanismo supone el uso de varios
conceptos como: etapa elemental, molecularidad, intermedios, catalizador,
número estequiométrico, etc. Una vez planteado el mecanismo tenemos que ser
capaces de llegar, a partir del mismo, a una ecuación cinética susceptible de
comprobación experimental.
La Energía de
activación
Es la energía que
necesita un sistema antes de poder iniciar un determinado proceso. La energía
de activación suele utilizarse para denominar la energía mínima necesaria para
que se produzca una reacción química dada. Para que ocurra una reacción entre dos
moléculas, éstas deben colisionar en la orientación correcta y poseer una
cantidad de energía mínima. A medida que las moléculas se aproximan, sus nubes
de electrones se repelen. Esto requiere energía (energía de activación) y
proviene del calor del sistema, es decir de la energía traslacional,
vibracional, etcétera de cada molécula.
Equilibrio químico
 Ocurre cuando, en una reacción reversible, la
velocidad de la reacción directa es igual a la velocidad de la reacción
inversa. Una vez alcanzado el estado de equilibrio, las concentraciones de
reactivos y productos permanecen constantes.
Ocurre cuando, en una reacción reversible, la
velocidad de la reacción directa es igual a la velocidad de la reacción
inversa. Una vez alcanzado el estado de equilibrio, las concentraciones de
reactivos y productos permanecen constantes.
complejo
activado
Es la disposición particular de los átomos en la
cima de la barrera energética. Si representamos su energía frente a todas las
coordenadas del sistema, generalmente veremos cómo es un mínimo energético en
todas ellas, menos en la coordenada de reacción -que lleva de los reactivos a
los productos-, en la que es un máximo.




0 comentarios